Presseinformation Novartis Pharma GmbH
ASCO 2018 – Neue Ergebnisse für Votrient® (Pazopanib) von Novartis zeigen Effektivität und Sicherheit bei Patienten mit mRCC unter Alltagsbedingungen
- Die Ergebnisse der zweiten Interimsanalyse der RWEA-Studie PAZOREALB zeigen, dass Pazopanib bei Patienten mit metastasiertem Nierenzellkarzinom (mRCCC) in der Routineanwendung effektiv und verträglich ist.1
- Bei Patienten, die auch für die Teilnahme an klinischen Studien qualifiziert gewesen wären, war die Behandlungsdauer (TDD) mit Pazopanib mit der von Patienten aus entsprechenden Studien2,3 vergleichbar.1
- Die Lebensqualität der Patienten mit mRCC, ermittelt anhand des EQ-5D-5LE, blieb während der Erstlinientherapie mit Pazopanib erhalten.1
Nürnberg, 02. August 2018 – Mit PAZOREAL wurde im Rahmen der 54.
Jahrestagung der American Society of Clinical Oncology (ASCO) 2018 in
Chicago (IL)/USA die zweite Interimsanalyse der RWE-Studie zum Einsatz
von Pazopanib (Votrient®) bei Patienten mit fortgeschrittenem
Nierenzellkarzinom (mRCC) vorgestellt. Sie bestätigt den
Tyrosinkinase-Inhibitor als effektive und sichere Therapieoption unter
Alltagsbedingungen.1 Pazopanib ist zur Behandlung von
erwachsenen Patienten mit fortgeschrittenem Nierenzellkarzinom und zur
Behandlung von Patienten indiziert, die zuvor eine Therapie ihrer
fortgeschrittenen Erkrankung mit Zytokinen erhalten hatten.4
In
die prospektive, bundesweite, multizentrische Beobachtungsstudie wurden
zwischen Dezember 2015 und November 2017 421 Patienten mit der
histologisch gesicherten Diagnose eines mRCC jeglichen Subtyps und einer
Lebenserwartung von mindestens sechs Monaten aufgenommen. Voraussetzung
für die Studienteilnahme war zudem die Entscheidung, die Patienten in
der Erstlinie mit Pazopanib oder in der Drittlinie mit Everolimus zu
behandeln. Der überwiegende Teil der Studienteilnehmer (80,3 %) wies ein
klarzelliges RCC auf, mehr als 10 % hatten einen ECOGF-Performance Status ≥ 2.5
Das primäre Studienziel war die Behandlungsdauer (TD) unter Pazopanib
in der Erstlinientherapie, definiert als der Zeitraum zwischen erster
und letzter Einnahme.1
PAZOREAL: Zweite Interimsanalyse
Aktuell
präsentiert wurden die Daten der zweiten geplanten Interimsanalyse der
Studie für 385 Patienten. Diese waren im Median 69,4 Jahre alt und
wurden in der Erstlinie mit Pazopanib behandelt.1 Bislang
erhielten vier dieser Patienten eine Zweitlinientherapie mit Everolimus
(± Lenvatinib) und 75 mit Nivolumab. Zwei Patienten wurden mit
Everolimus (± Lenvatinib) in der Drittlinie behandelt. Die mediane
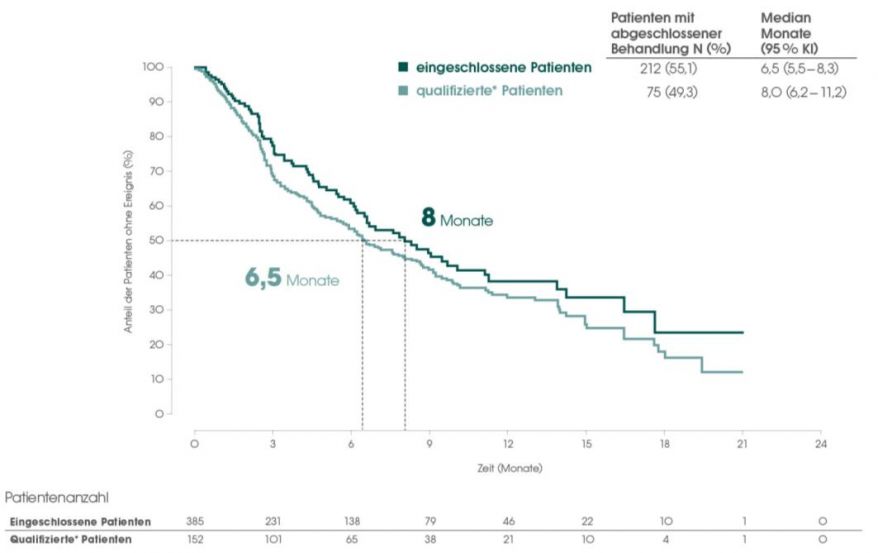
Behandlungsdauer unter Pazopanib in der Erstlinientherapie betrug in der
Gesamtstudienpopulation 6,5 Monate (95 %-Konfidenzintervall (KI):
5,5–8,3). „Für die 39,5 % der Patienten, die sich aufgrund ihrer
Basiseigenschaften auch für die Aufnahme in eine klinische
Zulassungsstudie qualifiziert hätten, betrug die TDD unter
Pazopanib 8,0 Monate“, berichtete Privatdozent Dr. Martin Bögemann,
Münster, der die Studie auf dem Kongress vorstellte (95 %-KI: 6,2–11,2;
Abbildung 1). Dieses Ergebnis entspreche den aus klinischen Studien2,3 zu Pazopanib bekannten Daten, so der Urologe.
Abbildung 1: PAZOREAL: Zeit unter Therapie mit Pazopanib in der Erstlinie, Vergleich der Gesamtstudienpopulation der Subgruppe der Patienten, die auch für die Teilnahme an einer klinischen Studie qualifiziert wären. Modifiziert nach Bögemann et al 2018.1
Abszisse: Zeit (Monate). Patienten unter Risiko; gesamt; für klinische Studien qualifiziert. Ordinate: Anteil der Patienten ohne Ereignis (%). Legende: Anzahl Patienten; Monate im Median (95 %-KI).
Sicher in der Routineanwendung
Unter der Erstlinientherapie mit Pazopanib wurden in 81,5 % der Fälle behandlungsbedingte unerwünschte Ereignisse (TEAEG)
beobachtet. Von diesen waren 65,1 % Pazopanib-bezogen (davon 19,8 % vom
Grad 3/4). Bei 50,6 % der Patienten wurde die Pazopanib-Dosis
reduziert, bei 12,7 % erhöht; 32,5 % der Studienteilnehmer unterbrachen
die Einnahme. Die anhand des EQ-5D-5LE ermittelte
Lebensqualität der Patienten blieb im Verlauf der Erstlinientherapie mit
Pazopanib stabil. Nach sechsmonatiger Therapie gaben 71,1 % der
Patienten an, keine Schmerzen oder Beschwerden zu haben (28,9 % ohne
Beschwerden). Zu Behandlungsbeginn gaben 27 % der Patienten an, keine
Schmerzen zu haben, während 69,4 % Beschwerden hatten. Für 3,6 % der
Patienten liegen keine Angaben vor.1 Insgesamt weisen die
Ergebnisse der Interimsanalyse auf eine nennenswerte Effektivität und
Sicherheit von Pazopanib in der Routineanwendung hin.
Beobachtungsstudie PRINCIPAL
In die gleiche Richtung deuten die Ergebnisse aus PRINCIPALH,
der größten prospektiven, multinationalen Beobachtungsstudie zur
generellen Bewertung der Wirksamkeit und Sicherheit von Pazopanib bei
Patienten mit mRCC unter Alltagsbedingungen, die ebenfalls beim ASCO
2018 vorgestellt wurden.6 Das mediane progressionsfreie Überleben (PFSI) betrug 10,3 Monate (95 %-KI: 9,2–12,0), das mediane Gesamtüberleben (OSJ)
29,9 Monate (95 %-KI: 24,7 – nicht erreicht). Damit waren die Werte für
das mediane PFS bzw. das mediane OS mit den in klinischen Studien2,3,7,8 ermittelten Werten vergleichbar.6 Gegenüber den klinischen Studien2,3 wurden niedrigere Raten für Hypertonie (22,8 %), Diarrhö (12,8 %) und Leberwerterhöhungen (ASTK) (7,0 %) festgestellt.6
Insgesamt konnte PRINCIPAL somit die Wirksamkeit und das
Sicherheitsprofil von Pazopanib bei Patienten mit mRCC im Alltagseinsatz
bestätigen.6 Limitationen der Studie liegen darin, dass
aufgrund des Studiendesigns der Beobachtungsstudie unerwünschte
Ereignisse potentiell untererfasst sein können und nur für eine relativ
geringe Anzahl an Patienten Follow-up-Tumordaten nach ≥ 30 Monaten
vorliegen. Zudem könnten die Daten zur Dauer bis zum Therapieansprechen
(TTRL) durch den vorgeschriebenen 3-Monats-Besuchsplan beeinflusst worden sein.1
„Daten
aus dem Praxisalltag, wie die aus PAZOREAL und PRINCIPAL, sind wichtig,
da sie die Ergebnisse aus klinischen Studien zu Pazopanib ergänzen und
andeuten, dass die Therapie mit dem Multi-Tyrosinkinase-Inhibitor auch
bei Patienten mit schlechterem ECOGF Performance-Status
effektiv und sicher sein kann“, betonte Bögemann.
Tyrosinkinase-Inhibitoren wie Pazopanib werden auch in Zukunft ihren
Stellenwert in der Therapie des mRCC behalten, zeigte sich der Urologe
überzeugt: „Zum einen aufgrund ihres bekannten und bewährten
Wirksamkeits- und Sicherheitsprofils, zum anderen aufgrund ihres
Potenzials in Kombinationstherapien, die derzeit getestet werden“,
schloss Bögemann.
Weitere Informationen zum Nierenzellkarzinom und den Therapieoptionen finden Sie unter www.onkologie-produktkompass.de, www.leben-mit-nierenkrebs.de und unter www.nierenzellkarzinom.info.
Über Votrient® (Pazopanib)
Das
„Small Molecule“ Votrient® (Pazopanib) ist zur Erstlinienbehandlung von
erwachsenen Patienten mit fortgeschrittenem Nierenzellkarzinom
zugelassen sowie zur Behandlung von Patienten, die vorher eine Therapie
ihrer fortgeschrittenen Erkrankung mit Zytokinen erhalten hatten.4
Im Juni 2010 wurde der potente Multi-Tyrosinkinase-Inhibitor, damals
als Produkt von GlaxoSmithKline (GSK), durch die Europäische
Arzneimittelbehörde (EMA) „unter Auflagen“ erstmalig zugelassen. Mit der
COMPARZ-Studie konnte Pazopanib seine Nicht-Unterlegenheit (Non
Inferiority) gegenüber Sunitinib beweisen (Auswertung der ITT -
Population).3 Aufgrund dieser Studie erfolgte im Juli 2013 die Umwandlung durch die EMA in eine Zulassung ohne Auflagen.9
Durch Transaktionen mit GSK ist das Produkt seit März 2015 Teil des
Onkologie-Portfolios von Novartis Oncology. Pazopanib ist ein
etablierter Standard in der Erstlinientherapie bei Patienten mit
niedrigem und mittlerem Risiko (nach MSKCCM-Risikokriterien).10 Die beiden europäischen Leitlinien der EAUN 201811 als auch der ESMOO 201612
und die amerikanischen Leitlinien der NCCNP 201613 empfehlen Pazopanib
in diesen Risikogruppen zur Erstlinientherapie beim metastasierten
Nierenzellkarzinom (mRCC) mit dem höchsten Empfehlungsgrad (1b), die
Leitlinien der EAU zudem auch bei hohem Risiko.11
A RWE: Real-World-Evidence
B PAZOREAL: PAZOpanib and Everolimus in a REAL-world Setting
C mRCC: metastatic Renal Cell Carcinoma
D TD: Time on Drug
E EQ-5D-5L: EuroQoL (Quality of Life) five-dimension, five-level health status questionnaire
F ECOG: Eastern Cooperative Oncology Group
G TEAE: Treatment-Emergent Adverse Event
H
PRINCIPAL: Observational study of real world effectiveness data and
safety in patients receiving pazopanib with advanced or metastatic renal
cell carcinoma
I PFS: Progression Free Survival
J OS: Overall Survival
K AST: aspartate aminotransferase level
L TTR: Time to Response
M MSKCC: Memorial Sloan Kettering Cancer Center
N EAU: European Association of Urology
O ESMO: European Society for Medical Oncology
P NCCN: National Comprehensive Cancer Network
1
Bögemann M, et al. Effectiveness and safety of pazopanib (PAZO) and
everolimus (EVE) in a changing treatment (Tx) landscape: Interim results
of the non-interventional study PAZOREAL. J Clin Oncol 2018;
36:Abstract 4584.
2 Sternberg CN, et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol 2010; 28:1061–1068.
3 Motzer RJ, et al. Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N Engl J Med 2013; 369:722–731.
4 Fachinformation Votrient® 200 mg/400 mg Filmtabletten.
5 Goebell P, et al. The PAZOREAL non-interventional study to assess efficacy and safety of pazopanib and everolimus in the changing metastatic renal cell carcinoma treatment landscape. Future Oncol 2017; 13:1463–1471.
6 Schmidinger M, et al. Prospective, multinational, observational study of real-world treatment outcomes with pazopanib in patients with advanced or metastatic renal cell carcinoma (PRINCIPAL Study). J Clin Oncol 2018; 36:Abstract 4574.
7 Sternberg CN, et al. A randomised, double-blind phase III study of pazopanib in patients with advanced and/or metastatic renal cell carcinoma: final overall survival results and safety update. Eur J Cancer 2013; 49:1287–1296.
8 Motzer RJ, et al. Overall survival in renal-cell carcinoma with pazopanib versus sunitinib. N Engl J Med 2014; 370:1769–1770.
9 Zusammenfassung des EPAR für die Öffentlichkeit. Votrient. Pazopanib. http://www.ema.europa.eu/docs/de_DE/document_library/EPAR_-_Summary_for_the_public/human/001141/WC500094273.pdf . Letzter Zugriff: 20.06.2018.
10 Maute L, Bergmann L. Systemtherapie des metastasierten Nierenzellkarzinoms. Onkologe 2015; 21:35–42.
11 Ljungberg B, et al. Guidelines on renal cell carcinoma. European Association of Urology 2018. Online unter:. https://uroweb.org/guideline/renal-cell-carcinoma/. Letzter Zugriff: 29.06.2018.
12 Escudier B, et al. Renal cell carcinoma: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016; 27:58–69.

Wir wollen Fachärzte und Pfleger topaktuell und wissenschaftlich fundiert über Studien, fachspezifische Entwicklungen und deren praktische Umsetzung informieren, um sie in ihrer Arbeit und Fortbildung zu unterstützen.
Wählen Sie dazu bitte Ihr Land aus.
Österreich
Deutschland
Schweiz
Andere