Presseinformation STADA Arzneimittel GmbH
02. Oktober 2025
Paradigmenwechsel in der IgAN-Therapie – Kinpeygo® erhält KDIGO Empfehlung
- Neue KDIGO Leitlinie zum Management der IgA-Nephropathie empfiehlt TrF-Budesonid Kinpeygo® (Studienname: Nefecon) als evidenzbasierte Therapie für die frühzeitige und ursächliche Behandlung der primären IgAN1
- 25% der Betroffenen entwickeln innerhalb von 10 Jahren eine terminale Niereninsuffizienz2
- Kinpeygo® ist die erste und einzige von der EMA zugelassene Therapie zur zielgerichteten und ursächlichen Behandlung der primären IgA-Nephropathie3
Wien, 26. September 2025 – Die IgA-Nephropathie (IgAN) – auch Morbus Berger genannt – ist die weltweit häufigste Form der Glomerulonephritis. Sie betrifft zwei- bis dreimal mal häufiger Männer als Frauen und wird häufig erst im Alter zwischen 30 und 40 Jahren diagnostiziert. Für die Betroffenen birgt sie einhohes Risiko, im Laufe des Lebens ein Nierenversagen zu erleiden.1 Das einzige zugelassene ursächliche P IgAN-Medikament, das TrF-Budesonid Kinpeygo®, findet nun mit seinem einzigartigen und kausalen Therapieansatz mit einer klaren Empfehlung der KDIGO Eingang in die KDIGO-Leitlinie.1
Kausales Therapiemanagement mit Kinpeygo®
Die Therapie der primären IgA-Nephropathie war lange Zeit auf symptomatische supportive Behandlungsoptionen der CKD-Krankheitskomponente begrenzt. Kinpeygo® (Studienname: Nefecon) bietet als einziges Medikament einen kausalen Therapieansatz, der die zugrundeliegende Pathogenese der IgAN direkt adressiert. Mit seiner einzigartigen Wirkweise, der zielgerichteten Wirkstofffreisetzung, reduziert Kinpeygo® lokal im distalen Ileum die Bildung von gd-IgA innerhalb der B-Zellen und verringert somit die Bildung von pathogenen IgA-Immunkomplexen.4
Seit seiner Zulassung 2022 hat sich Kinpeygo® zur zielgerichteten Behandlung der Erkrankungsursache als wichtiger Bestandteil der modernen IgAN-Therapie etabliert. Die Bedeutung eines zielgerichteten und ursächlichen Behandlungsansatz wurde nun mit der Aufnahme in den Leitlinien der Kidney Disease: Improving Global Outcomes (KDIGO) betont. In der neuen Leitlinie zum Management der IgA-Nephropathie wird Kinpeygo® für die Behandlung der primären IgAN mit Empfehlungsgrad 2b empfohlen.1 Die Leitlinie berücksichtigt die Evidenz klinischer Studien bis August 2024 mit dem Ziel, den behandelnden Ärzten aktuelle Empfehlungen zur Diagnose, Prognose und Behandlung zur Verfügung zu stellen.1 Die neue Leitlinie wurde am 18.09.2025 im Rahmen des 18. International Symposium on IgA Nephropathy (IIgANN) in Prag vorgestellt und publiziert.
Paradigmenwechsel in der IgAN-Therapie
Die KDIGO Leitlinie 2025 sieht für das Therapiemanagement der IgAN als neues konstantes Behandlungsziel eine Reduktion des Nierenfunktionsverlustes auf ein physiologisches Level von < 1 ml/min/1,73m2 vor.1 Der bislang einzige validierte Biomarker für die IgAN, die Proteinurie, sollte dabei mindestens auf < 0,5 g/Tag oder idealerweise auf < 0,3 g/Tag reduziert werden, dieses Behandlungsziel trifft auf die meisten IgAN-Patienten, mit Ausnahme von Patienten mit ausgeprägter Nierenvernarbung, zu.1
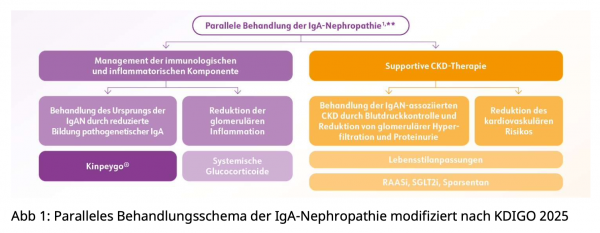
Bei Patienten mit einem hohen Progressionsrisiko (Progredienter Nierenfunktionsverlust; d.h. Proteinurie ≥ 0,5 g/Tag) sollte eine parallele Behandlung beider Erkrankungsarme angestrebt werden, wie unter anderem aus dem von der KDIGO empfohlenen Therapieschema hervorgeht*:
Die neue Leitlinie schärft das Therapiebestreben neben dem Management der CKD-Komponente auch die Immunkomponente der Erkrankung gezielt zu adressieren, um den Krankheitsverlauf zu verlangsamen und die Nierenfunktion möglichst lange zu erhalten.1
Hier kommt Kinpeygo® als einziger zugelassene Therapie, die frühzeitig und gezielt am Ursprung der Erkrankung ansetzt3,5 eine zentrale Rolle zu. Daher wird es mit Empfehlungsgrad 2b für die Therapie der IgAN-spezifischen Krankheitskomponente von der KDIGO empfohlen.1
Studiendaten von Kinpeygo® belegen krankheitsmodifizierenden Effekt
Die Phase-3-Zulassungsstudie NefIgArd zeigt, dass mit Kinpeygo® behandelte Patienten nach einem 9-monatigen Therapiezyklus und einer Follow-Up Periode von 15 Monaten eine 50 % geringere Reduktion der eGFR im Vergleich zur Kontrollgruppe aufweisen.5 Auch die Reduktion der UPCR konnte über 24 Monate Behandlungs- bzw. anschließenden Beobachtungszeitraum nachhaltig um 30 % versus Kontrollgruppe reduziert werden.5 Zusätzlich zeigte sich in der Phase-II-NEFIGAN-Studie eine signifikante Reduktion der gd-IgA Spiegel in der Kinpeygo®-Gruppe versus Placebo, was den krankheitsmodifizierenden Effekt von Kinpeygo® belegt.6
Zusätzlich deuten Daten einer Modellierungsanalyse von Real-World-Daten darauf hin, dass Kinpeygo® die Zeit bis zum Nierenversagen um bis zu 12,8 Jahre versus ausschließlich supportiver Therapie verzögern könnte (Medianzeit bis Nierenversagen Kinpeygo® 22,4 Jahre; Ausschließlich supportive Therapie 9,6 Jahre).#,7 Diese Daten betonen die Relevanz der in den Leitlinien geforderten frühzeitigen Reduktion der IgA-Spiegel und IgA-Immunkomplexe-Bildung.1
1 Kidney Disease: Improving Global Outcomes (KDIGO) IgAN and IgAV Work Group. KDIGO 2025 Clinical Practice Guideline for the Management of Immunoglobulin A Nephropathy (IgAN) and Immunoglobulin A Vasculitis (IgAV). Kidney Int. 2025;108(4S):S1-S71
2 Pitcher D et al. Clin J Am Soc Nephrol. 2023;18(6)727-738
3 Fachinformation Kinpeygo® 4 mg Hartkapseln mit veränderter Wirkstofffreisetzung, Stand 09/24.
4 Yeo SC, Barratt J. Clin Kidney J. 2023;16(Suppl 2):ii9-ii18.
5 Lafayette R, et al. Lancet. 2023;402(10405):859-870.
# Modellierungsanalyse von Real-World-Daten. Ein lineares Regressionsmodell wurde verwendet, um die Wirkung von Kinpeygo® auf den eGFR-Slope in der NefIgArd-Studie zu extrapolieren und dessen Einfluss auf das Eintreten eines Nierenversagens in einer Real-World-Kohorte vorherzusagen
6 Fellström, Bengt C et al.The Lancet, Volume 389, Issue 10084, 2117 - 2127
7 Barratt J et al. eGFR slope modelling predicts long-term clinical benefi t with nefecon in a real-world IgAN population, Clin Kidney J 2025; 18(2): sfae404.
** Der Einschluss in klinische Studien sollte geprüft werden1
* Kinpeygo® ist zur Behandlung von Erwachsenen mit primärer
Immunglobulin A-Nephropathie (IgAN) mit einer Proteinausscheidung im Urin von ≥ 1,0
g/Tag (bzw. einer Protein/Kreatinin-Ratio im Urin von ≥ 0,8 g/ Gramm) angezeigt.3
Über Kinpeygo®
Kinpeygo ist zur Behandlung von primärer Immunglobulin A (lgA)-Nephropathie (lgAN) bei Erwachsenen mit einer Proteinausscheidung ≥ 1g/Tag (bzw. einer UPCR von ≥ 0,8 g/Gramm) zugelassen.3 Mit der Phase 3-NefIgArd-Studie wurde zum ersten Mal ein Medikament zur Behandlung der IgAN aufgrund von Proteinurie-Verlaufsdaten nach 12 Monaten vorläufig zugelassen. Die volle Zulassung durch die EMA erfolgte dann aufgrund der positiven Ergebnisse der Gesamtstudie über 2 Jahre.
Über die STADA Arzneimittel AG
Die STADA Arzneimittel AG hat ihren Sitz im hessischen Bad Vilbel. Das Unternehmen setzt auf eine Drei-Säulen-Strategie bestehend aus Consumer-Healthcare-Produkten, Generika und Spezialpharmazeutika. Weltweit vertreibt die STADA Arzneimittel AG ihre Produkte in mehr als 100 Ländern. Im Geschäftsjahr 2024 erzielte STADA einen Konzernumsatz von 4.059 Millionen Euro und ein Ergebnis vor Zinsen, Steuern und Abschreibungen (EBITDA) von 886 Millionen Euro. Zum 31. Dezember 2024 beschäftigte STADA weltweit 11.649 Mitarbeiter.
340_KIN_0925
Kinpeygo 4 mg Hartkapseln mit veränderter Wirkstofffreisetzung
Qualitative und quantitative Zusammensetzung: Jede Hartkapsel mit veränderter Wirkstofffreisetzung enthält 4 mg Budesonid. Sonstige(r) Bestandteil(e) mit bekannter Wirkung. Jede Kapsel enthält 230 mg Saccharose . Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1. der Fachinformation. Anwendungsgebiete: Kinpeygo ist zur Behandlung von Erwachsenen mit primärer Immunglobulin A-Nephropathie (IgAN) mit einer Proteinausscheidung im Urin von ≥ 1,0 g/Tag (bzw. einem Protein/ Kreatinin-Ratio im Urin von ≥ 0,8 g/Gramm) angezeigt. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 der Fachinformation genannten sonstigen Bestandteile. Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C). Pharmakotherapeutische Gruppe: Antidiarrhoika und intestinale Antiphlogistika/Antiinfektiva, Corticosteroide mit lokaler Wirkung, ATC-Code: A07EA06. Inhaber der Zulassung: STADA Arzneimittel AG, 61118 Bad Vilbel, Deutschland. Örtlicher Vertreter: STADA Arzneimittel GmbH, Muthgasse 36/2, 1190 Wien. Rezeptpflicht/Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Weitere Angaben zu Nebenwirkungen, Wechselwirkungen mit anderen Arzneimitteln oder sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit, Gewöhnungseffekten und zu den Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung sind der veröffentlichten Fachinformation zu entnehmen. Stand der Information: 02.2025

Wir wollen Fachärzte und Pfleger topaktuell und wissenschaftlich fundiert über Studien, fachspezifische Entwicklungen und deren praktische Umsetzung informieren, um sie in ihrer Arbeit und Fortbildung zu unterstützen.
Wählen Sie dazu bitte Ihr Land aus.
Österreich
Deutschland
Schweiz
Andere